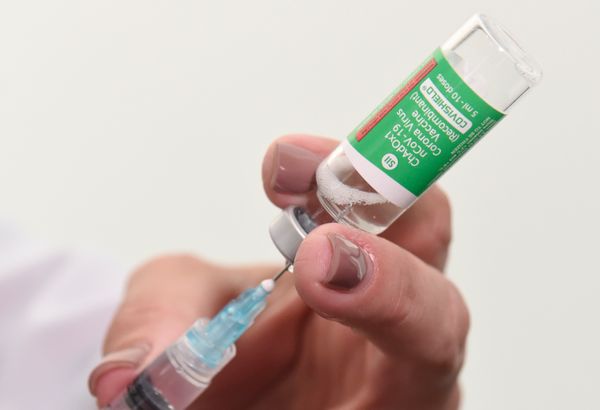
A Anvisa aprovou nesta sexta-feira (12) o registro definitivo da vacina contra Covid-19 desenvolvida pela Universidade de Oxford e a AstraZeneca e produzida no Brasil pela Fiocruz.
A medida permite o uso da vacina em larga escala no país, já que a autorização para uso emergencial, concedida em 17 de janeiro, referia-se a 2 milhões de doses importadas da Índia e permitia sua aplicação apenas em grupos prioritários.
Agora, as vacinas produzidas pela instituição também ganham autorização para serem aplicadas, e não há mais restrição de público-alvo.
A expectativa da Fiocruz é produzir até 222 milhões de doses da vacina neste ano. O processo, no entanto, tem enfrentado atrasos devido à dificuldade para importar da China os insumos usados na produção. Para este mês, são previstos 3,8 milhões de doses.
O registro não permite a venda ao setor privado, já que a Fiocruz visa venda apenas ao SUS e a organismos multilaterais.
Segundo Gustavo Mendes, gerente-geral de medicamentos da Anvisa, para a aprovação do registro a agência analisou características da vacina, processo de fabricação, estratégia de controle do processo, controle de qualidade e estabilidade, entre outros.
No Brasil, a eficácia geral da vacina foi de 64,2%. Em indivíduos com comorbidades, a taxa foi de 73,4%. Já entre a população com 65 anos ou mais, os dados são limitados, diz a agência. Entretanto, estudos pós-autorização indicam boa efetividade em idosos a partir da primeira dose.
Mendes acrescenta que ainda há incerteza sobre alguns pontos da vacina: segurança a longo prazo, em idosos, em relação ao intervalo de doses, sobre as formas graves da doença e em populações especiais, como crianças, adolescente, gestantes e indivíduos imunossuprimidos.
Os benefícios superam os riscos, os dados dão suporte ao registro do produto e não vislumbra um risco à saúde da população relacionada a utilização da vacina e a nossa recomendação é seguir para o registro, diz.
Nesta semana, nove países europeus Itália, Dinamarca, Noruega, Islândia, Áustria, Estônia, Lituânia, Letônia e Luxemburgo suspenderam temporariamente a aplicação de vacinas contra Covid-19 fabricadas pela AstraZeneca para se certificarem de que elas não têm ligação com efeitos colaterais mais graves.
A agência regulatória de medicamentos da União Europeia (EMA) fará uma reavaliação da vacina. A agência afirmou que, desde o início da vacinação, foram registrados 22 casos de trombose em mais de 3 milhões de pessoas vacinadas nos 30 países do Espaço Econômico Europeu (que compreende a UE, a Noruega, a Islândia e Lichtenstein). O número de "eventos tromboembólicos em pessoas vacinadas não é superior ao observado na população em geral", acrescentou.
A AstraZeneca afirmou que segurança é prioridade da empresa e que os ensaios clínicos não revelaram efeitos colaterais graves: "Os reguladores têm padrões claros e rigorosos de eficácia e segurança para a aprovação de qualquer novo medicamento, e isso inclui a vacina contra Covid-19.
Peter English, presidente do comitê de medicina de saúde pública da Associação Britânica de Medicina, afirmou que não é incomum que a introdução de uma nova vacina seja interrompida por relatos de eventos adversos.
"É um sinal de que os sistemas de monitoramento de reações adversas estão funcionando; mas, em geral, não indica que as reações estejam sendo causadas pelas vacinas", afirmou. Segundo ele, além de estudos que tentem entender uma relação causal, um dos aspectos mais importantes é comparar a incidência de casos com a que ocorre na população em geral.
Notou alguma informação incorreta no conteúdo de A Gazeta? Nos ajude a corrigir o mais rapido possível! Clique no botão ao lado e envie sua mensagem
Envie sua sugestão, comentário ou crítica diretamente aos editores de A Gazeta