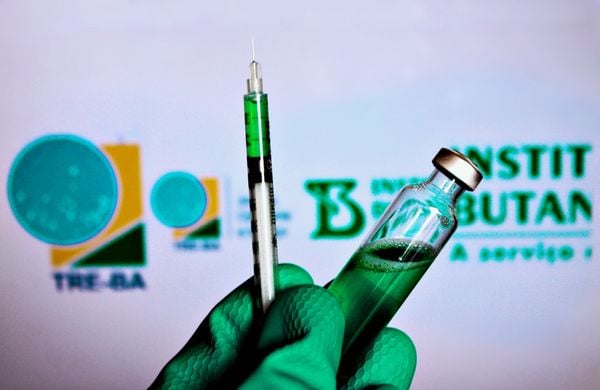
A Anvisa (Agência Nacional de Vigilância Sanitária) marcou para domingo (17) uma reunião dos diretores da agência para decidir sobre a autorização de uso emergencial de vacinas contra a Covid-19.
Notou alguma informação incorreta no conteúdo de A Gazeta? Nos ajude a corrigir o mais rapido possível! Clique no botão ao lado e envie sua mensagem
Envie sua sugestão, comentário ou crítica diretamente aos editores de A Gazeta