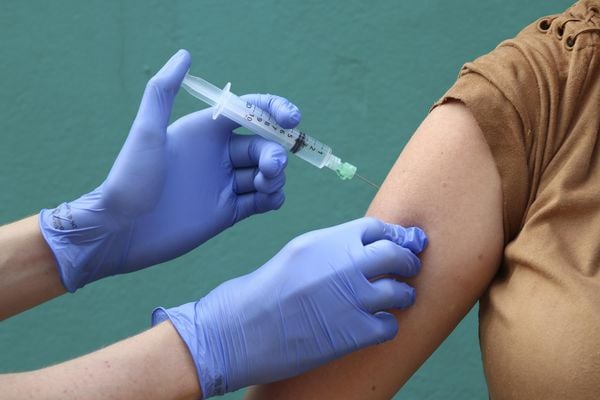
Mesmo sem ter nenhuma vacina com eficácia comprovada no mundo, o Ministério da Saúde afirma ter garantido a aquisição de 140 milhões de doses de imunizantes contra o coronavírus. O governo federal ainda acompanha mais de 200 estudos que buscam a identificação de um composto contra a Covid-19.
Durante o Talk Show CBN 2020, realizado nesta quarta-feira (14), o secretário de Estado da Saúde, Nésio Fernandes, afirmou que o Espírito Santo está se preparando para começar a imunizar a população contra a Covid-19 em janeiro de 2021, caso até lá já haja vacina aprovada e disponível no Brasil.
Um relatório divulgado pela Organização Mundial de Saúde (OMS) apontou que há no momento 33 vacinas em fase de experimentos clínicos, das quais 10 estão na etapa mais adiantada, chamada fase 3. Outras 143 estão em fase pré-clínica.
Entre eles, quatro compostos estão sendo testados no Brasil: o produzido pela farmacêutica americana Pfizer em parceria com a alemã BioNTech; a vacina da AstraZeneca, desenvolvida na Universidade de Oxford; a chinesa Coronavac, feita em parceria entre o Instituto Butantan com a chinesa Sinovac; além da Janssen-Cilag, da Johnson & Johnson.
Os estudos das quatro vacinas com voluntários brasileiros foram autorizados pela Agência Nacional de Vigilância Sanitária (Anvisa). De acordo com o órgão federal, as pesquisas estão na fase 3 (estudos clínicos em humanos). Mas, diante desse cenário, o que falta para a vacina ser aprovada no Brasil?
A doutora em Saúde Coletiva e Epidemiologia, Ethel Maciel, explicou que as duas vacinas com maior possibilidade de serem aprovadas são as fórmulas da AstraZeneca, desenvolvida na Universidade de Oxford; e a chinesa Coronavac, feita em parceria com o Instituto Butantan e a chinesa Sinovac. As duas estão na fase 3.

Questionada sobre uma provável data para aprovação do registro de uma vacina contra o vírus, a Anvisa informou por nota que "não dá prazo já que o estudo é conduzido pelos centros de pesquisa e está sujeito à imprevisibilidades típicas do processo de pesquisa". O órgão acrescenta que a Anvisa tem adotado "critérios para que os processos sejam avaliados da forma mais ágil possível, sem abrir mão dos critérios de segurança e eficácia.
Uma das preocupações da população é a definição do público que deve receber num primeiro momento a dose da vacina contra o coronavírus. De acordo com o secretário de Estado da Saúde, Nésio Fernandes, é baixa a probabilidade de ter vacina contra o coronavírus para crianças em um primeiro momento.
Segundo Fernandes, isso acontecerá porque as vacinas em produção estão sendo testadas exclusivamente em adultos e será priorizado o grupo de risco. De acordo com a cientista-chefe da OMS, Soumya Swaminathan, jovens saudáveis podem ter que esperar até 2022 para serem vacinados contra o novo coronavírus.
Ela declarou que profissionais de saúde, idosos e trabalhadores que lidam com o público mais suscetível devem ser os primeiros a serem imunizados quando uma vacina viável estiver disponível. Swaminathan estima que vacinas comprovadamente seguras e eficazes podem estar disponíveis no próximo ano, mas ainda não em quantidade suficiente para toda a população.
No Brasil, o governo federal ressaltou que a distribuição da vacina seguirá os trâmites do que já é praticado nas campanhas de vacinação do Sistema Único de Saúde (SUS): as doses serão enviadas aos estados - que farão a entrega aos municípios de sua respectiva região. Os grupos prioritários para vacinação estão sendo estudados pelo Programa Nacional de Imunizações.
"O Ministério está em constante avaliação de novas possibilidades e permanece em contato com o Butantan e outros institutos nacionais que buscam parcerias com laboratórios estrangeiros. O imunizante que ficar pronto primeiro o que significa atender todos os critérios de segurança e eficácia exigidos pela Anvisa - será uma opção para aquisição", informou, por nota, o Ministério a Saúde.
O médico infectologista Lauro Ferreira Pinto está otimista em relação à chegada de uma vacina eficaz, mas alerta que ainda é preciso cautela, principalmente, na Grande Vitória, onde os números apontam um crescimento dos casos confirmados e mortes provocadas pelo vírus. Segundo ele, é preciso aguardar o resultado da fase 3 dos estudos clínicos desenvolvidos no Brasil.

Está na terceira e última fase de testes em seres humanos. Médicos e enfermeiros voluntários de seis estados brasileiros participam da testagem. O governador de São Paulo, João Doria, disse que o composto começa a ser aplicado na população paulista em dezembro deste ano, caso a vacina seja aprovada pela Anvisa.
Os resultados preliminares das fases 1 e 2 da vacina com mais de mil pessoas mostraram que ela foi capaz de induzir uma resposta imune à doença. As fases dois (que ainda está ocorrendo no Reino Unido) e três de testes (acontecendo no Reino Unido, Brasil e África do Sul) devem garantir a eficácia completa dela.
A vacina está na fase três de testes e usa o RNA mensageiro, que tem como objetivo produzir as proteínas antivirais no corpo do indivíduo. A expectativa é testar a vacina em aproximadamente 30 mil voluntários com idades entre 18 e 85 anos no mundo. Desse total, mil serão testados no Brasil. A expectativa é que a eficácia da vacina seja comprovada até o outubro. A empresa espera produzir até 100 milhões de doses até o fim do ano.
Os testes da fase 3 da vacina da farmacêutica belga foram autorizados no Brasil no dia 18 de agosto. O estudo prevê a inclusão de até 60 mil voluntários, com idade entre 18 e 60 anos, sendo 7 mil no País - distribuídos nos Estados de São Paulo, Rio Grande do Sul, Rio de Janeiro, Paraná, Minas Gerais, Bahia e Rio Grande do Norte. Não há informações sobre os resultados alcançados até o momento.
O Ministério da Saúde informa que já firmou duas parcerias - com o laboratório AstraZeneca e a Universidade de Oxford e com o consórcio Covax Facility - que somam a aquisição de 140 milhões de doses para a população brasileira.
A intenção é disponibilizar aos brasileiros, tão cedo quanto possível, uma vacina eficaz, em quantidade e qualidade para atender a população, informou a nota do Ministério.
Depois de cumprir as etapas da fase não clínica, a empresa deve realizar estudos clínicos em três fases (I, II e III) para avaliar e determinar a segurança e a eficácia do uso da vacina em humanos. Cada etapa cumpre objetivos específicos no âmbito do desenvolvimento do produto.
Notou alguma informação incorreta no conteúdo de A Gazeta? Nos ajude a corrigir o mais rapido possível! Clique no botão ao lado e envie sua mensagem
Envie sua sugestão, comentário ou crítica diretamente aos editores de A Gazeta